
详细介绍:
中国临床试验注册中心(ChiCTR)
介绍及图文攻略 - 与ClinicalTrials.gov对比分析
为研究者提供实用的注册攻略和平台对比
ChiCTR平台介绍
基本信息
-
官方网址:
https://www.chictr.org.cn -
承办单位:
四川大学华西医院 -
建立时间:
2005年建立,2007年正式运行 -
国际地位:
WHO国际临床试验注册平台一级注册机构
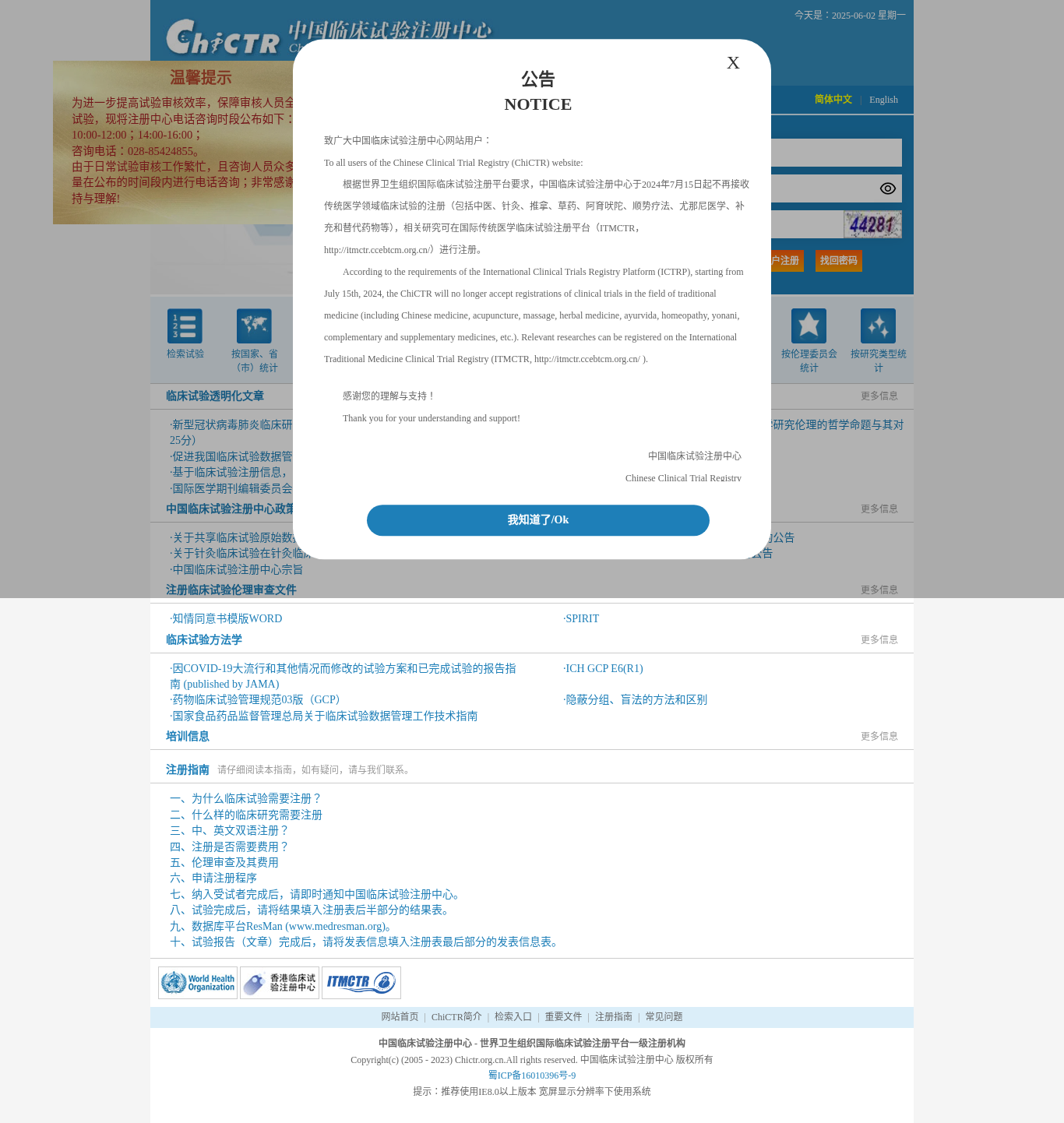
重要公告
2024年7月15日起重要变更:
根据WHO国际临床试验注册平台要求,ChiCTR不再接收传统医学领域临床试验注册(包括中医、针灸、推拿、草药等)。相关研究请在国际传统医学临床试验注册平台(ITMCTR)进行注册。
联系方式
- 咨询电话:028-85424855
- 咨询时间:工作日 10:00-12:00;14:00-16:00
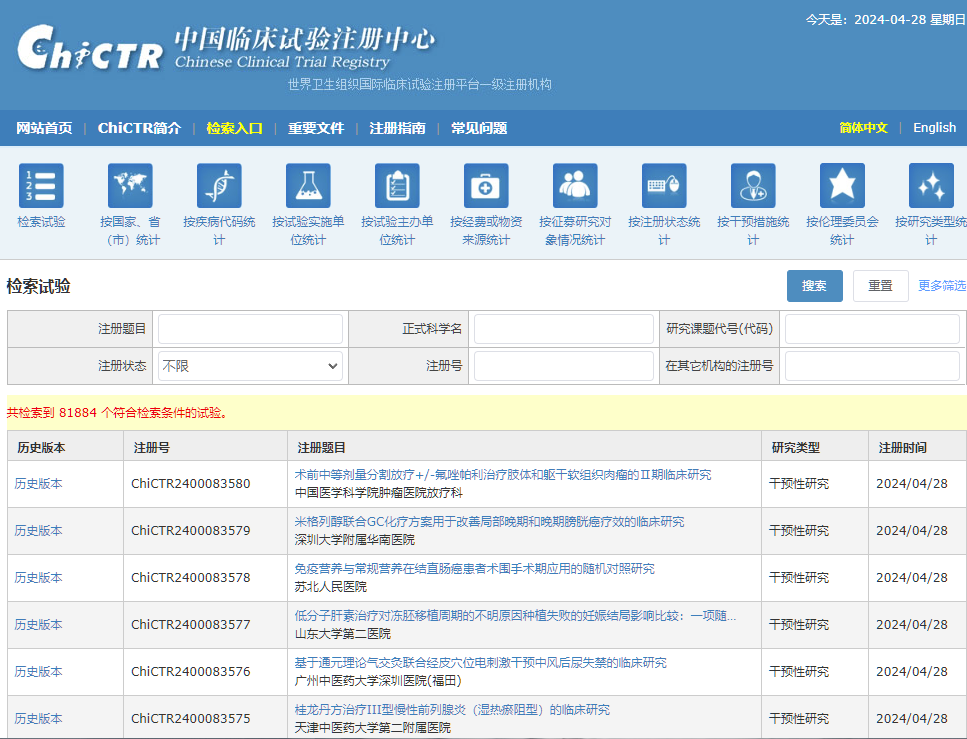
核心功能特点
试验注册管理
提供完整的临床试验注册流程,支持中文界面,便于国内研究者使用
信息检索查询
支持多维度检索,包括按国家、省市、疾病代码、实施单位等统计查询
质量控制
核查一稿多投,避免重复发表,确保研究质量和学术诚信
国际互联
与WHO国际平台同步,注册信息向全球开放,提升研究国际影响力
标准化管理
按照WHO ICTRP标准要求,提供20个条目信息和27类38个条款
数据统计
提供详细的试验统计数据,支持研究趋势分析和政策制定
注册流程指南
账户注册
- 访问 ChiCTR 首页右侧"用户登录"区
- 点击"注册"按钮
- 填写个人信息注册表
- 完成邮箱验证
试验信息准备
准备以下关键信息:
- 研究题目
- 研究类型
- 主要研究者信息
- 研究机构
- 干预措施
- 主要终点指标
- 样本量计算
- 伦理委员会批件
在线填写注册表
- 登录账户,选择"注册新试验"
- 按照WHO标准填写20个必填条目
- 上传相关证明文件
- 仔细检查信息准确性
提交审核
- 提交注册申请
- 等待专家审核(通常5-10个工作日)
- 接收审核结果通知
- 如需修改,按要求补充完善
获得注册号
- 审核通过后获得ChiCTR注册号
- 试验信息在平台公开展示
- 与WHO国际平台同步
- 可用于期刊投稿
操作攻略详解
账户创建技巧
- 邮箱选择:建议使用机构邮箱,提高账户可信度
- 信息完整性:填写详细的个人和机构信息,有助于审核通过
- 密码安全:设置复杂密码,包含大小写字母、数字和特殊字符
- 联系信息:确保联系方式准确,便于接收审核通知
信息填写要点
必填信息清单
- • 试验标题(中英文)
- • 研究类型分类
- • 主要研究者信息
- • 研究机构详情
- • 资助来源
- • 伦理委员会信息
- • 研究对象纳排标准
- • 干预措施描述
- • 主要终点指标
- • 样本量及计算依据
常见错误避免
- • 避免试验标题过于简单
- • 不要遗漏关键的包含/排除标准
- • 确保样本量计算合理
- • 干预措施描述要具体
- • 主要终点要明确可测量
- • 时间节点要符合实际
- • 联系信息要保持最新
- • 伦理批件号要准确
- • 注册时机要合适
- • 文件格式要符合要求
时间节点把控
最佳注册时机
- • 首例患者入组前
- • 伦理委员会批准后
- • 研究方案确定后
审核周期
- • 初审:3-5个工作日
- • 专家审核:5-10个工作日
- • 修改补充:视情况而定
注意事项
- • 避免试验开始后注册
- • 预留充足的审核时间
- • 及时响应审核意见
中美平台对比分析
ChiCTR - 中国临床试验注册中心
ClinicalTrials.gov - 美国临床试验注册库
| 对比维度 | ChiCTR | ClinicalTrials.gov |
|---|---|---|
| 建立时间 | 2005年建立,2007年运行 | 2000年建立运行 |
| 管理机构 | 四川大学华西医院 | 美国国立卫生研究院(NIH) |
| 界面语言 | 中文/英文双语 | 英文为主 |
| 注册流程 | 需专家审核,5-10个工作日 | 自助注册,即时生效 |
| 费用 | 免费 | 免费 |
| 国际认可 | WHO一级注册机构 | WHO一级注册机构 |
| 数据要求 | WHO标准20个条目 | FDAAA 801规定数据集 |
| 结果报告 | 试验完成后更新 | 强制要求结果报告 |
| 质量控制 | 专家审核机制 | 自动检查+人工审核 |
| 特色功能 | 中文友好,审核严格 | 数据丰富,分析工具强 |
ChiCTR优势
- 中文界面,国内研究者易上手
- 专家审核,确保注册质量
- 符合中国法规要求
- 与国际标准接轨
- 技术支持响应及时
ClinicalTrials.gov优势
- 全球最大的试验注册库
- 即时注册,流程简便
- 数据分析工具丰富
- 国际影响力最大
- 与FDA监管直接关联
国际标准要求
WHO国际临床试验注册平台(ICTRP)标准
核心注册数据集(20个条目)
注册时机要求
- 首例受试者入组前必须完成注册
- 最迟不超过开始招募后21天
- 研究方案确定后尽早注册
- 伦理委员会批准后注册
质量标准
- 信息准确完整
- 及时更新状态
- 公开透明原则
- 避免重复注册
ICMJE期刊要求
发表前提
- • 必须预先注册
- • 提供注册号
- • 符合时间要求
认可平台
- • WHO一级机构
- • ChiCTR
- • ClinicalTrials.gov
审稿检查
- • 注册号验证
- • 时间点核查
- • 信息一致性
实用技巧建议
注册成功秘诀
提前准备
- • 研究方案要完整详细
- • 伦理委员会批件要获得
- • 研究团队信息要齐全
- • 预留充足注册时间
信息质量
- • 标题要准确反映研究内容
- • 纳排标准要明确具体
- • 主要终点要可测量
- • 样本量计算要合理
沟通配合
- • 及时响应审核意见
- • 主动联系技术支持
- • 保持信息更新及时
- • 遵守平台使用规范
常见问题解决
注册被退回
主要原因及解决方案:
- • 信息不完整 → 补充完善所有必填项
- • 伦理证明不符 → 提供有效的伦理批件
- • 研究方案不清 → 提供详细的研究方案
- • 联系方式错误 → 核实并更正联系信息
审核时间过长
可能原因及处理方式:
- • 节假日因素 → 合理安排注册时间
- • 信息复杂 → 主动联系确认进度
- • 需要补充材料 → 及时提供所需文件
- • 系统故障 → 联系技术支持团队
注册号使用
正确使用注册号:
- • 论文投稿时正确引用
- • 格式要求按期刊标准
- • 确保号码准确无误
- • 及时更新试验状态
选择平台建议
选择ChiCTR适用于
- • 国内研究者
- • 中文材料较多
- • 需要专业指导
- • 符合国内法规
选择ClinicalTrials.gov适用于
- • 国际多中心研究
- • 快速注册需求
- • 美国相关研究
- • 全球影响力研究
双平台注册
- • 提高国际曝光度
- • 满足不同期刊要求
- • 确保合规性
- • 扩大影响范围
相关资源链接
指导文件
- WHO ICTRP标准
- ICMJE要求
- 技术支持:028-85424855
实用工具
- 样本量计算器
- 试验检索工具
- 数据导出功能
联系信息
ChiCTR技术支持
- 电话:028-85424855
- 时间:工作日 10:00-12:00;14:00-16:00
- 地址:四川大学华西医院
ClinicalTrials.gov支持
- Email:[email protected]
- 在线教程:PRS Guided Tutorials
- 帮助文档:How to Apply Guide

 执业医师资格考试培训
执业医师资格考试培训 免费试听
免费试听 执业药师考试培训
执业药师考试培训
