
详细介绍:
国家医学研究登记备案信息系统
medicalresearch.org.cn
国家卫生健康委员会科技教育司官方平台,为医疗机构、高校、科研院所提供涉及人的生命科学和医学研究备案管理服务
系统概览
国家医学研究登记备案信息系统是国家卫生健康委员会科技教育司建设的官方平台,由中国医学科学院医学信息研究所提供技术支持,实现医学研究全生命周期备案监管。
主管部门
国家卫生健康委员会科技教育司
技术支持
中国医学科学院医学信息研究所
备案编号
京ICP备10218182号-22
系统登录界面
主要功能模块
系统涵盖机构管理、人员管理、伦理委员会备案、研究项目登记等全方位功能
机构管理
- 医疗机构管理
- 高等院校管理
- 科研院所管理
- 行政机关管理
人员管理
- 人员添加与导入
- 角色权限管理
- 批量操作功能
- 信息维护更新
伦理委员会管理
- 伦理委员会备案
- 成员信息管理
- 年度报告上传
- 换届注销流程
研究项目备案
- 项目基本信息
- 研究设计方案
- 招募信息管理
- 数据共享设置
监管功能
- 全生命周期监管
- 合规性检查
- 审查流程管理
- 信息透明公开
系统对接
- 与ChiCTR对接
- 数据同步功能
- 减轻重复填报
- 一站式服务
系统界面展示
直观的界面设计,简化操作流程
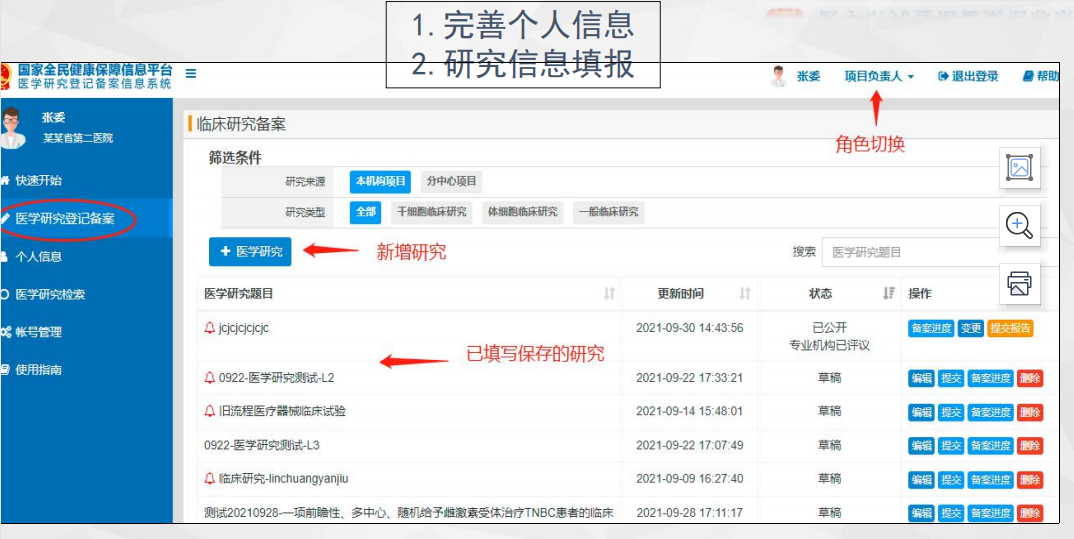
系统主界面导航

备案流程示意图
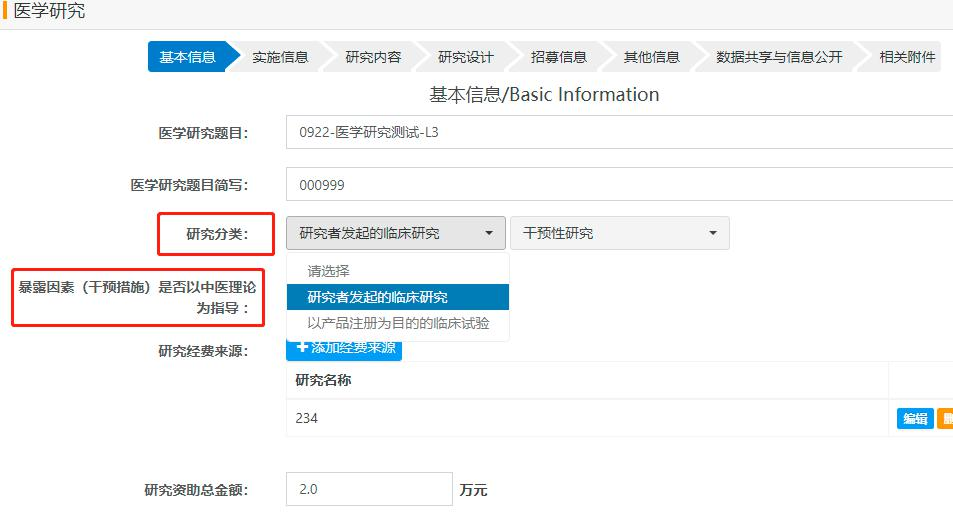
项目信息填写界面
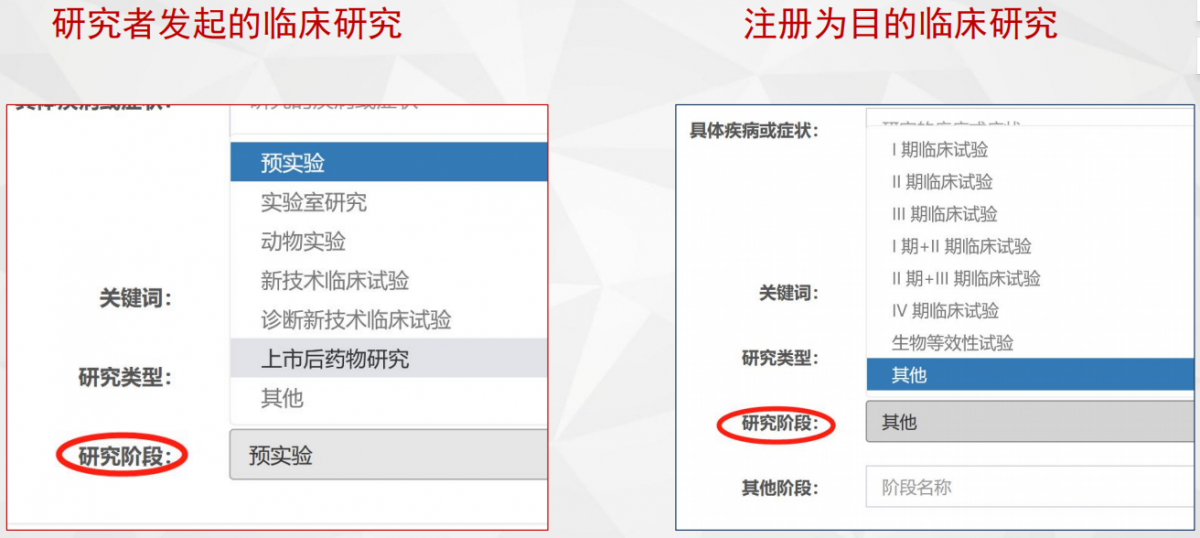
审核流程管理界面
操作流程指南
从注册到项目备案完成的详细步骤
阶段一:账号准备与机构设置
机构账号创建
医疗机构、高校、科研院所首先创建机构主账号,完成基础信息录入。
注意:建议使用微软Edge、谷歌Chrome、火狐Firefox等主流浏览器访问系统
下级单位管理
创建和管理下属科室、学院、院所等二级单位信息。
人员添加与角色分配
添加相关人员,分配项目负责人、伦理委员会秘书等角色权限。
阶段二:伦理委员会备案
伦理委员会信息录入
伦理委员会秘书登录系统,填写委员会基本信息和成员详情。
要求:委员会总人数不少于7人,设主任、副主任委员,任期不超过5年
机构审核确认
提交伦理委员会备案信息,等待机构管理员审核确认。
年度报告维护
每年3月31日前提交上一年度伦理委员会工作报告。
阶段三:医学研究项目备案
项目信息填报
项目负责人登录系统,按模块填写项目完整信息。
基本信息模块
- • 项目名称与分类
- • 负责人信息
- • 资助来源
研究设计模块
- • 研究类型
- • 样本量计算
- • 主要终点指标
伦理审查
伦理委员会秘书对提交的项目进行初步审查。
机构终审
机构管理员进行最终审核,确认项目真实性和合规性。
时限要求:项目获得伦理批件后,须在30日内完成备案
备案完成与公示
审核通过后,项目信息在系统中公开展示,完成备案流程。
重要政策法规
医学研究备案相关的法律法规依据
《涉及人的生物医学研究伦理审查办法》
- 机构应在伦理委员会设立后3个月内备案
- 研究项目须在实施前完成伦理审查
- 年度报告提交要求
- 信息公开透明原则
《医疗技术临床应用管理办法》
- 临床研究项目管理规范
- 医疗机构主体责任
- 技术风险评估要求
- 质量安全监管机制
《干细胞临床研究管理办法》
- 干细胞研究备案要求
- 机构资质认定
- 研究方案审查
- 全程质量控制
《传染病防治法》相关规定
- 传染病临床试验规范
- 应急响应机制
- 数据共享要求
- 国际合作管理
系统对接功能
减轻重复填报负担,实现一站式服务
与中国临床试验注册中心对接
自动同步功能
备案信息自动同步至ChiCTR平台,无需重复填报
数据一致性保障
确保两个平台数据的一致性和准确性
注册号获取
审核完成后自动获得临床试验注册号

系统对接流程示意图
对接优势
节省时间
减少重复录入工作
提高准确性
避免信息不一致
国际认可
符合国际标准
常见问题解答
使用过程中的常见问题及解决方案
Q1: 如何申请系统账号?
机构首次使用需要联系系统管理员申请机构主账号,个人用户则由所属机构的管理员创建账号并分配相应角色权限。
Q2: 忘记密码怎么办?
可通过登录界面的"忘记密码"功能,或联系机构管理员重置密码。管理员可在人员管理模块中为用户重置密码。
Q3: 项目备案有时间限制吗?
是的,根据规定,医疗机构批准临床研究项目立项后,应当在30日内完成备案。建议在获得伦理批件后尽快进行备案。
Q4: 项目信息可以修改吗?
已备案的项目可以进行信息变更,需要项目负责人提交修改申请,经伦理委员会秘书审核和机构确认后生效。
Q5: 伦理委员会备案需要哪些材料?
需要提供伦理委员会设立文件、委员资质证明、工作制度、标准操作程序等相关材料,具体要求可查看系统使用指南。
Q6: 如何获得技术支持?
可通过系统内的微信群获得技术支持,也可以查看"使用指南"中的详细操作手册,或联系中国医学科学院医学信息研究所。
联系方式与技术支持
我们为您提供全方位的技术支持和服务
© 国家卫生健康委员会科技教育司 | 技术支持:中国医学科学院医学信息研究所 | 京ICP备10218182号-22
建议使用微软Edge、谷歌Chrome、火狐Firefox、360等主流浏览器浏览本网站

 执业医师资格考试培训
执业医师资格考试培训 免费试听
免费试听 执业药师考试培训
执业药师考试培训
